Primera Ley de la TermodinámicaLa primera ley de la termodinámica, es la aplicación del principio de conservación de la energía, a los procesos de calor y termodinámico: La primera ley hace uso de los conceptos claves de energía interna, calor, ytrabajo sobre un sistema. Usa extensamente el estudio de los motores térmicos. La unidad estándar de todas estas cantidades es el julio, aunque algunas veces se expresan en calorías o BTU. En los textos de Química es típico escribir la primera ley como ΔU=Q+W. Por supuesto que es la misma ley, -la expresión termodinámica del principio de conservación de la energía-. Exactamente se define W, como el trabajo realizadosobre el sistema, en vez de trabajo realizado por el sistema. En un contexto físico, el escenario común es el de añadir calor a un volumen de gas, y usar la expansión de ese gas para realizar trabajo, como en el caso del empuje de un pistón, en un motor de combustión interna. En el contexto de procesos y reacciones químicas, suelen ser mas comunes, encontrarse con situaciones donde el trabajo se realiza sobre el sistema, mas que el realizado por el sistema.
| ||
EntalpíaEn la termodinámica de reacciones químicas y en los procesos no cíclicos son útiles cuatro cantidades llamadas "potenciales termodinámicos". Estos son laenergía interna, la entalpía, la energía libre de Helmholtz y la energía libre de Gibbs. La entalpía se define porSe trata de una cantidad útil en el seguimiento de las reacciones químicas. Si como resultado de una reacción exotérmica se libera un poco de energía de un sistema, tiene que aparecer de alguna forma medible en función de las variables de estado. Un incremento de la entalpía H = U + PV se debería asociar con un incremento en la energía interna que podría medirse por la calorimetría, o por el trabajo realizado por el sistema, o por una combinación de los dos. La energía interna U podría considerarse como, la energía necesaria para crear un sistema en ausencia de cambios en la temperatura o el volumen. Pero si el proceso cambia el volumen, como en las reacciones químicas que producen productos gaseosos, entonces se debe realizar trabajo para producir cambio en el volumen. En un proceso a presión constante, el trabajo que debemos realizar para producir un cambio de volumen ΔV es PΔV. Por tanto el término PV se puede interpretar como el trabajo que se debe hacer para "crear espacio" para el sistema, si se presume que empezó con un volumen cero.
| ||
Trabajo del SistemaNormalmente es un gas el que realiza el trabajo en un sistema termodinámico. El trabajo realizado por un gas a presión constante es:
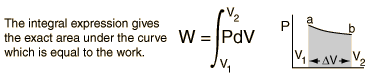 El trabajo realizado por un sistema disminuye la energía interna del sistema, como se indica en la primera ley de la termodinámica. El trabajo del sistema es un aspecto importante en el estudio de los motores térmicos. |
Segunda Ley de la Termodinámica

| |||||||||
Segunda Ley: Motores TérmicosSegunda ley de termodinámica: es imposible extraer una cantidad de calor QH de un foco caliente, y usarla toda ella para producir trabajo. Alguna cantidad de calor QC debe ser expulsada a un foco frío. Esto se opone a un motor térmico perfecto.A veces se denomina la "primera forma" de la segunda ley, y es conocida como el enunciado de la segunda ley de Kelvin-Planck. 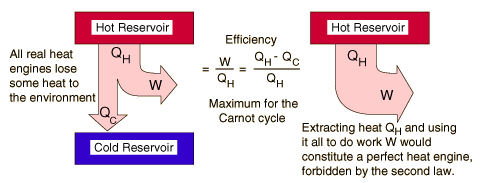
| ||
Segunda Ley: El RegrigeradorSegunda ley de la termodinámica: No es posible que el calor fluya desde un cuerpo frío hacia un cuerpo mas caliente, sin necesidad de producir ningún trabajo que genere este flujo. La energía no fluye espontáneamente desde un objeto a bajatemperatura, hacia otro objeto a mas alta temperatura. Esto se opone al perfectorefrigerador. Las declaraciones sobre los refrigeradores, se aplican a los acondicionadores de aire y a las bombas de calor, que encarnan los mismos principios.Esta es la "segunda forma", o la declaración de Clausius de la segunda ley. 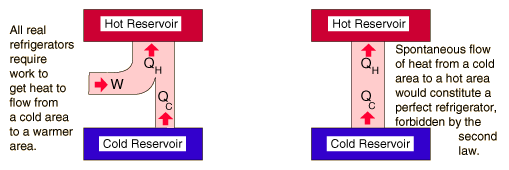
| ||
Segunda Ley: EntropíaSegunda ley de la termodinámica: en cualquier proceso cíclico, la entropía aumentará, o permanecerá igual.
|
Problema
1º Los sistemas A y B son sales paramagnéticas con
coordenadas ( H , M ) y ( H ’, M ’) respectivamente, mientras que el sistema C
es un gas con coordenadas ( p,V ). Cuando A y C están en equilibrio térmico se
cumple: nRcH − MpV = 0, y cuando lo están B y C se cumple: EMBED
Equation.3 pV M –nR (c H + aM ) = 0
a) ¿Cuáles
son las funciones, del par de variables de cada sistema, iguales entre si en el
equilibrio térmico?
b) ¿Cuál
es la relación que expresa el equilibrio térmico entre los sistemas A y B?
Solución:
a) Partiendo de las relaciones entre los sistemas en el
equilibrio, las funciones del par de variables iguales entre sí en el
equilibrio son:
M
M pV – nR (c H +
aM) = 0 à pV = nR(c H + aM) = pV = nRcH = nR(c H + aM)
M M M
b) La relación en el equilibrio entre los sistemas A y B
la extraemos a partir de la relación obtenida en el apartado a):
M M M M
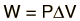


No comments:
Post a Comment